14 – BIOMINERAIS EM CARAPAÇAS DE CARAMUJO (LITTORINA SP.), TURU (NEOTEREDO REYNEI) E CARANGUEJO (UCIDES CORDATUS) DO MANGUEZAL DE SÃO CAETANO DE ODIVELAS, PARÁ, BRASIL
Ano 05 (2018) - Número 03 Artigos
![]() 10.31419/ISSN.2594-942X.v52018i3a14CRLM
10.31419/ISSN.2594-942X.v52018i3a14CRLM
Christiene R. L Matos¹, Marcondes Lima da Costa², José Francisco Berredo³
¹Universidade Federal do Pará, UFPA, Doutoranda no Programa de Pós-Graduação em Geologia e Geoquímica-PPGG, christienematos@hotmail.com
² Programa de Pós-Graduação em Geologia e Geoquímica (PPGG), Universidade Federal do Pará, marcondeslc@gmail.com
³Museu Paraense Emílio Goeldi, MPEG, Pesquisador, berredo@museu-goeldi.br
ABSTRACT
X-ray diffraction, X–ray fluorescence and scanning electron microscopy are used to determine the biominerals and chemical composition in mangrove Neoteredo reynei (mollusk, bivalve), Littorina sp. (mollusk, gastropod) and Ucides cordatus (arthropod, crustacea) shells. The shells of mollusks studied are composed of calcite and aragonite. Calcite is the main biomineral, and unique in the crab shell. The X-ray diffractograms, Sr, MgO and P2O5 values suggest the presence of amorphous calcium phosphates and carbonates in the crab shells. K2O indicates the presence of illite as mineral from the sediments that surround these shells and Na as halite from mangrove environment.
Keywords: Calcite, aragonite, calcium carbonate.
INTRODUÇÃO
A biomineralização refere-se aos processos pelos quais os seres vivos sintetizam minerais (Lowenstam e Weiner, 1989; Weiner e Dover, 2003) que procedem e progridem em estreita relação com matrizes ou moléculas orgânicas. Cerca de 60 minerais já foram identificados como produtos da biomineralização, e assim genericamente denominados de biomerais (Lowenstam e Weiner, 1989; Weiner e Dover, 2003). Entre eles se destacam calcita e aragonita, constituindo as conchas de moluscos, pérolas e corais; apatita nos esqueletos de mamíferos e aves; opala e polimorfos de SiO2 como cristobalita nas diatomáceas ou nos espongiários; magnetita em certas bactérias; bem como barita, gipsita, pirita e galena, entre outros (Lowenstam e Weiner, 1989; Prozorov 2015; Arasuna e Okuno, 2018).
Os biominerais mais frequentes tem o cálcio como um dos elementos principais (Lowenstam e Weiner 1989). Isso não é surpresa, porque o cálcio cumpre muitas funções fundamentais no metabolismo celular (Berridge et al. 1998). Calcita, aragonita, vaterita e apatita são os mais abundantes. A calcita, entre os polimorfos de CaCO3, é a forma mais estável enquanto aragonita e vaterita são metaestáveis (De Yoreo 2015; Evans 2017).
Os manguezais são ecossistemas muito sensíveis às mudanças físico-químicas e ricos em matéria orgânica e nutrientes e sustentam uma biomassa muito grande de flora e fauna. Nos manguezais é possível observar grande quantidade de animais, cujas carapaças são construídas com biominerais, calcita, aragonita e apatita, principalmente aquelas de crustáceos (por exemplo, siri, caranguejo, cracas) e moluscos (por exemplo, mexilhão, turu, caramujos, ostras). Este estudo investigou a composição mineralógica de três espécies da fauna (caramujo – Littorina sp., turu – Neoteredo reynei e caranguejo – Ucides cordatus) encontradas no manguezal de São Caetano de Odivelas, no nordeste do Estado do Pará, costa norte do Brasil.
MATERIAIS E MÉTODOS
As coletas de amostras de caranguejos (Ucides cordatus), caramujos (Littorina sp.) e turus (Neoteredo reynei) foram realizadas em maio de 2018, no manguezal de São Caetano de Odivelas, às margens do rio Mojuim, cujo estuário é delimitado pelos paralelos: 00º 35’ 00” S e 47º 03’ 45” W, 00º 52’ 30” S e 48º 05’ 00” W.
As amostras de caramujos foram coletadas manualmente em troncos de árvores caídos no manguezal. As amostras de carapaças de turu foram coletadas aleatoriamente em segmento de Rhizophora mangle em estado inicial de decomposição, com aproximadamente 30 cm de comprimento e 20 cm de diâmetro. Os caranguejos foram coletados, por um catador, através da técnica de braceamento (coleta com o braço).
No laboratório de campo, fez-se a limpeza da parte externa de cada animal, consistindo na retirada da lama e lavagem com água corrente. As amostras foram acondicionadas em sacos plásticos e levadas ao laboratório para triagem. As carapaças das amostras foram secas a temperatura de 60ºC até peso constante, e posteriormente foram pulverizadas.
As identificações mineralógicas foram realizadas por Difração de Raios-X (DRX), pelo método do pó em difratômetro (Bruker D2 PHASER), enquanto os teores de CaO, MgO, Fe2O3 e P2O5 (%) por determinados por fluorescência de Raios-X (Bruker, S1 Turbo S), equipamentos estes do Laboratório de Mineralogia e Geoquímica Aplicada (LAMIGA) do Instituto de Geociências da UFPA. A micromorfologia e as análises químicas semiquantitativas de fragmentos das carapaças foram observadas através de microscópio eletrônico de varredura-MEV (TESCAN MIRA3) com sistema de energia dispersiva-EDS (Oxford instruments x-act), no Laboratório de MEV/EDS do Museu Paraense Emílio Goeldi. Os fragmentos (sem tratamento químico, apenas lavados com água destilada) foram montados nos suportes para MEV usando-se fita de carbono e cola de prata, e então metalizados com ouro. As análises químicas por MEV/EDS nesses mesmos fragmentos ocorreram em condições de 15 kV e as imagens de 5 kV.
RESULTADOS
As carapaças de caramujos são dominadas por calcita e aragonita, as de turus por calcita com aragonita restrita, enquanto a de caranguejo, apenas calcita (Figura 1).

Figura 1: Difratogramas de raios-X de amostras de carapaças de Littorina sp (caramujo) (A), Neoteredo reynei (turu) (B) e Ucides cordatus (caranguejo) (C).
Os dados das análises químicas (Tabela 1) confirmam o domínio desses minerais, todos carbonatos de cálcio, representados pelas altas concentrações de CaO, com 72,5% na carapaça de caramujo, 68,6% na de turu e 59,8% na carapaça de caranguejo. Os teores totais de CaO estão acima do valor estequiométrico para 100% de calcita/aragonita (que é de 56,03% de CaO), que deve corresponder imprecisão analítica decorrente da análise direta sobre o material conchífero, sem qualquer tratamento prévio.
As análises mostram ainda que essas carapaças contêm concentrações significativas de MgO e P2O5. Os valores de MgO mais elevados foram observados nos caramujos, e em geral devem fazer parte da composição dos carbonatos. Como a presença de magnésio favorece a formação de aragonita em vez de calcita, o MgO na carapaça de caranguejo, constituída apenas de calcita, pode ser atribuído a presença também de carbonato de cálcio amorfo servindo como intermediário (Raz et al., 2000; Mann, 2001). De fato, o difratograma de raios x (Figura 1 C) mostra forte ruído de fundo indicativo da presença de material amorfo, ao contrário dos demais, com elevada cristalinidade. Os teores de P2O5 são mais elevados no caranguejo (3,16 %), esse valor sugere a presença de fosfato de cálcio e/ou magnésio, tipo apatita, que é frequente como biomineral em vertebrados e invertebrados (Weiner e Dover, 2003), o que corresponderia a cerca de 7,5 % desse mineral. É provável que os fosfatos de cálcio estejam também como fase amorfa, com destaque para a carapaça de caranguejo.
Os teores de Sr variaram de 0,15 a 0,53 %, sendo mais elevados na carapaça de caranguejo. Este elemento se aloja preferencialmente na estrutura da aragonita (Dauphin e Denis, 2000), que não foi identificada na concha deste animal, mas pode estar como carbonato de Ca amorfo. Teor de 0,41 % de K2O foi encontrado na carapaça do caranguejo, o que poderia representar a presença de pequena quantidade de argilomineral agregado às carapaças, como illita, que é comum nos sedimentos de mangue dessa região (Vilhena et al. 2010). Os teores de Fe2O3 são inexpressivos, < 0,09 %, enquanto os de Cl alcançam 0,24%, que podem representar pequenas quantidades de sais, sejam de Ca e Mg, ou ainda Na (que não é possível de ser determinado pelo método empregado) e/ou ainda como parte da estrutura de fosfatos de cálcio amorfos, precursores da apatita como indicado anteriormente. A composição química identificada nas carapaças da região estudada, também foram em carapaças de outras espécies de moluscos (Dauphin et al. 2000, Vengadesan e Kumar 2016) e crustáceos (Boßelmann et al. 2007).
Tabela 1: Composição química parcial das amostras de carapaças de caramujo (Littorina sp), turu (Neoteredo reynei) e caranguejo (Ucides cordatus) do manguezal de São Caetano de Odivelas.
| Componente químico (%) | Caramujo
(Littorina sp.) |
Turu
(Neoteredo reynei) |
Caranguejo
(Ucides cordatus) |
|---|---|---|---|
| CaO | 72,5 | 68,6 | 59,8 |
| MgO | 7,56 | 3,92 | 4,49 |
| P2O5 | 1,14 | 1,07 | 3,16 |
| Fe2O3 | 0,03 | 0,09 | 0,06 |
| K2O | – | – | 0,41 |
| Sr | 0,25 | 0,15 | 0,53 |
| Cl | 0,16 | 0,11 | 0,24 |
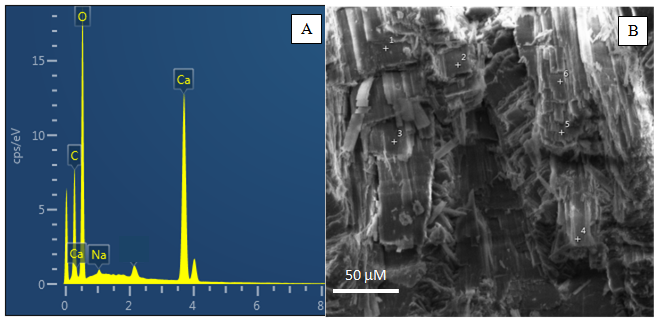
A composição química elementar obtida por espectroscopia de energia dispersiva de raios-X (EDS) demonstrou alta concentração de cálcio, oxigênio e carbono como componentes principais (Figura 2), o que confirma a presença de CaCO3 na carapaça do caramujo Littorina sp. Sódio está presente em baixa concentração, provavelmente devido ao NaCl residual da água do mar.
As análises químicas qualitativas obtidas por MEV/EDS confirmam a presença de Ca, Mg, Sr, P e Cl, já quantificados por FRX, além de C e Na na carapaça do caranguejo Ucides cordatus (Figura 3). Portanto, se confirma a possível presença de halita, inferida pelas análises de FRX, que indica a participação da água salina, além de fosfatos, provavelmente na forma de fosfato de cálcio amorfo, como observado em várias espécies de crustáceos (Becker et al. 2005, Boßelmann et al. 2007, Neues et al. 2007).
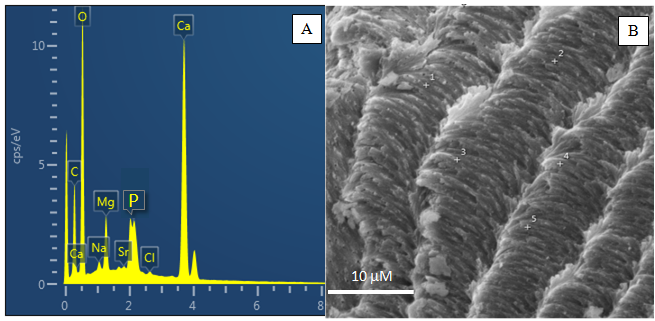
A constituição mineral a base de calcita e aragonita das carapaças de bivalves e gastrópodes já é bastante conhecida. A frágil camada externa (camada prismática) é formada de calcita ou aragonita e a camada interna (camada nacarada) resistente composta por agregados de placas de aragonita (depositados em lâminas ou colunas), quitina e proteínas (Blank et al. 2003, Addadi et al. 2006, Barthelat et al. 2007), fato comprovado na carapaça do caramujo Littorina sp. Num fragmento com espessura de 1,2 mm é possível identificar 2 camadas principais (Figura 4A), e que no detalhe à superfície interna permite reconhecer agregados de placas de aragonita, intercrescidas entre si (Figura 4B).

Figura 4: (A) Fragmento da carapaça do caramujo com cerca de 1,2 mm de espessura, onde se delineia 2 camadas principais. (B) A camada mais interna (camada nacarada) a direita é formada por agregados de placas de aragonita.
O exoesqueleto ou cutícula (carapaça) do caranguejo, calcita e carbonato de cálcio amorfo estão estabelecidos na matriz quitina-proteína (Roer e Dillaman, 1984; Dillaman et al. 2005; Chen et al. 2008). São duas camadas, epicutícula, que é a mais externa, é composta por um complexo de proteínas e lipídios que é a principal barreira de impermeabilização, e a segunda, a procutícula, camada mais interna, responsável pela rigidez e resistência do exoesqueleto. A procutícula por sua vez compreende duas partes, a exocutícula (externa) e a endocutícula (interna), compostas por uma matriz de quitina e proteínas, disposta em lamelas paralelas entre si, que são empilhados em uma estrutura helicoidal ou Bouligand (Chen et al. 2008; Naleway et al. 2016), constatados nas carapaças do caranguejo estudado (Figura 5). Na Figura 5B é possível observar sucessivas camadas paralelas constituídas de fibras deslocadas em relação umas às outras, de modo que as superfícies da fratura aparecem multi-lameladas. Uma série de canais (Figura 5C) atravessam as lamelas tanto da exocutícula quanto da endocutícula, conforme observado também em outras espécies de caranguejo por Chen et al. 2008 e Aurognzeb 2009.

Figura 5: (A) Imagem da camada interna (endocutícula) da carapaça de caranguejo estudada ilustrando a estruturação em camadas ou lamelas. (B) Detalhe da estrutura em camadas. (C) Ressalte das camadas com os canais.
CONCLUSÕES
As carapaças de moluscos e crustáceos estudados em sedimentos de manguezais de São Caetano de Odivelas são compostas principalmente de calcita e aragonita, em que o primeiro é o principal biomineral, e único na carapaça de caranguejo. Os difratogramas de raios X, os valores de Sr, MgO e P2O5 sugerem a presença de carbonatos e fosfatos de cálcio amorfos nas carapaças de caranguejo. K2O indica a presença de illita como mineral dos sedimentos que envolvem essas carapaças e Na como halita, do ambiente subsalino do mangue.
Agradecimentos
Aos laboratórios LAMIGA do Museu de Geociências do IG/UFPA pelas análises de DRX e FRX e ao Dr. Hilton Túlio do Museu Paraense Emílio Goeldi pelo auxilio nas análises de MEV/EDS. A CAPES e CNPQ pela concessão de bolsa de estudo ao primeiro autor e ao CNPQ pela bolsa de produtividade em pesquisa e taxa de bancada (Processo no. 305015/2016-8) ao segundo autor.
REFERÊNCIAS
Addadi L., Joester D., Nudelman F., Weiner S. 2006. Mollusk shell formation: a source of new concepts for understanding biomineralization processes. Chemistry, 12: 980–987.
Arasuna, A. and Okuno, M. 2018. Structural change of the frustule of diatom by thermal treatment. Geoscience Letters, 5: 1.
Aurognzeb D. 2009. Origin of high strength and nanophotonic properties of crab shell (Paralithodes camtschaticus). Journal of Applied Physics, 105: 056108-1.
Barthelat F., Tang H., Zavattieri P.D., Li C.M., Espinosa, H.D. 2007. On the mechanics of mother-of-pearl: a key feature in the material hierarchical structure. J. Mech. Phys. Solids., 55: 306–337.
Becker A., Ziegler A., Epple M. 2005. The mineral phase in the cuticles of two species of Crustacea consists of magnesium calcite, amorphous calcium carbonate, and amorphous calcium phosphate. Dalton Transactions, 1814–1820.
Berridge M.J., Bootman M.D., Lipp P. 1998. Calcium-A life and death signal. Nature, 395: 645-648.
Blank S., Arnoldi M., Khoshnavaz S., Treccani L., Kuntz M., Mann K., Grathwohl G., Fritz M. 2003. The nacre protein perlucin nucleates growth of calcium carbonate crystals, J. Microsc. (Oxford), 212: 280–291.
Boßelmann F., Romano P., Fabritius H., Raabe D., Epple M. 2007. The composition of the exoskeleton of two crustacea: The American lobster Homarus americanus and the edible crab Cancer pagurus. Thermochimica Acta, 463: 65–68.
Chen P.-Y., Lin A.Y.M., McKittrick J., Meyers M.A. 2008. Structure and mechanical properties of crab exoskeletons. Acta Biomater, 4: 587–596.
Dauphin Y. and Denis A. 2000. Structure and composition of the aragonitic crossed lamellar layers in six species of Bivalvia and Gastropoda. Comparative Biochemistry and Physiology Part A, 126: 367–377.
De Yoreo J.J., Gilbert P.U.P.A., Sommerdijk N.A.J.M., Penn R.L., Whitelam S., Joester D., Zhang H., Rimer J.D., Navrotsky A., Banfield J.F. et al. 2015. Crystallization by particle attachment in synthetic, biogenic, and geologic environments. Science, 349: 498–510.
Dillaman R., Hequembourg S., Gay M. 2005. Early Pattern of Calcification in the Dorsal Carapace of the Blue Crab, Callinectes sapidus. Journal of Morphology, 263: 356–374.
Evans J.S. 2017. Polymorphs, Proteins, and Nucleation Theory: A Critical Analysis. Minerals, 7: 62.
Lowenstam H.A. and Weiner S. 1989. On Biomineralization. Oxford University Press, Oxford.
Mann S. 2001. Biomineralization: principles and concepts in bioinorganic materials chemistry. Oxford: Oxford University Press.
Naleway S.E., Taylor J.R.A., Porter M.M., Meyers M.A., McKittrick J. 2016. Structure and mechanical properties of selected protective systems in marine organisms. Materials Science and Engineering C., 59: 1143–1167.
Neues F., Ziegler A., Epple M. 2007. The composition of the mineralized cuticle in marine and terrestrial isopods: A comparative study. Cryst. Eng. Comm., 9: 1245–1251.
Prozorov T. 2015. Magnetic microbes: Bacterial magnetite biomineralization. Seminars in Cell & Developmental Biology, 46: 36–43.
Raz S., Weiner S., Addadi L. 2000. Formation of high magnesian calcites via an amorphous precursor phase: possible biological implications. Adv Mater, 2000: 38–42.
Roer R. and Dillaman R. 1984. The Structure and Calcification of the Crustacean Cuticle. Amer. Zool., 24: 893-909.
Vengadesan R. and Kumar G.R.S. 2016. Comparative study on chemical characteristics and biominerals in Meretrix casta (chemnitz, 1782) shells of vellar and Yadayanthittu estuaries, southeast coast of India. IJARBEST, v. 2, Issue 4, April.
Vilhena M.P.S.P., Costa M.L, Berredo J.F. 2010. Continental and marine contributions to formation of mangrove sediments in an Eastern Amazonian mudplain: The case of the Marapanim Estuary. Journal of South American Earth Sciences, 29: 427–438.
Weiner S. and Dove P.M. 2003. An Overview of Biomineralization Processes and the Problem of the Vital Effect. Rev. Mineral. Geochem., 54: 1–29.