10 – SÍNTESE DE SODALITA A PARTIR DE REJEITO DE CAULIM DA AMAZÔNIA ATRAVÉS DE EXTRUSÃO DA MISTURA REACIONAL SEGUIDO POR PROCESSO HIDROTERMAL
Ano 05 (2018) - Número 02 Artigos
![]() 10.31419/ISSN.2594-942X.v52018i2a10ALG
10.31419/ISSN.2594-942X.v52018i2a10ALG
Angelina Lobato Gonçalves*/Abaetetuba/Pará/Brasil/angelina02goncalves@hotmail.com
Ana Áurea Barreto Maia*/ Abaetetuba/Pará/Brasil/anabmaia@yahoo.com.br
* (Universidade Federal do Pará)
ABSTRACT
The objective of the present work was to synthesize zeolites through the extrusion process using a kaolin residue. In the first part of this work, the synthesis was carried out at a mean temperature of 90ºC, evaluating as main variable the time of 20 and 24 h. Thus, the first series of syntheses was carried out in 3 stages, described as follows: (1) thermal treatment of kaolin waste at 700 ° C / 2h to obtain metakaolinite; (2) formation of the reaction mixture in 3 proportions to perform the extrusion and drying at 90 ° C / 24 h. (3) the dried samples were taken to the hydrothermal process, observing the two times of synthesis. In the second round of synthesis, the mean temperature used was 110 ° C for both the drying and the hydrothermal process, the synthesis times were 20, 24 and 48h and the formation of the reaction mixture followed other ratios. The starting material, kaolin tailings, and synthesis products were characterized by X-ray diffractometry, scanning electron microscopy and chemical analysis. No zeolitic material was formed in the first series of experiments. However, the conditions used in the second series led to the formation of sodalite in all synthetic products.
Keywords: Kaolin waste, Zeolite, Extrusion.
INTRODUÇÃO
O estado do Pará desponta no cenário nacional com um grande potencial mineralógico, devido às inúmeras reservas de minérios encontradas em seu território. Com isso, várias empresas do setor de bens manufaturados, a partir de minérios, acabam sendo atraídas para se instalarem na região. Conforme o Instituto Brasileiro de Mineração (IBRAM), as empresas que agregam 95% da produção nacional de caulim são: Caulim da Amazônia S.A. (CADAM), Pará Pigmentos S. A. (PPSA) e Imerys Rio Capim Caulim S. A. (IRCC), as quais, devido a sua grande demanda de produção, acabam gerando uma quantidade significativa de rejeitos industriais (Ibram, 2012).
O rejeito gerado pelas empresas, acima citadas, é proveniente do processo de beneficiamento do caulim. Neste ocorre a formação de dois principais rejeitos, constituídos por: quartzo (cerca de 10% da produção) e caulim (cerca de 26% da produção). O caulim classificado como rejeito recebe esta nomenclatura por apresentar granulometria (< 2 μm) inadequada para produção de papel (Maia et al 2011, 2014; Santos et al 2013). Entretanto, a utilização desse rejeito como matéria prima de outros processos industriais, possibilita a diminuição de impactos ambientais e do custo na produção de novos materiais.
Assim, alguns grupos de pesquisa, dentre eles o Grupo de Mineralogia e Geoquímica Aplicada (GMGA) da Universidade Federal do Pará, desenvolvem trabalhos para estudar as propriedades e possíveis aplicações deste material, como: produção de alumina para cerâmica (Flores e Neves, 1997), refratários (Martelli 2006), pozolanas (Barata 2007), e em ênfase neste trabalho, a síntese de zeólitas (Maia 2007, 2011; Maia et al 2007, 2011, 2014, 2015a, 2015b; Paz et al 2010; Santana et al 2012; Hildebrando et al 2012; Moraes et al 2013; Rocha Júnior 2015; Santos 2015).
Conforme Luz (1994), as zeólitas englobam um grande número de minerais naturais e sintéticos que apresentam características comuns. São alumino silicatos hidratados de metais alcalinos ou alcalinos terrosos (principalmente sódio, potássio, magnésio e cálcio), estruturados em redes cristalinas tridimensionais, compostos de tetraedros do tipo TO4 (T = Si, Al, B, Ge, Fe, P, Co) unidos nos vértices por meio de átomos de oxigênio. Por apresentarem uma estrutura micro porosa, as zeólitas apresentam a propriedade de transferir matéria entre os espaços intracristalinos, no entanto, essa transferência é limitada pelo diâmetro dos poros das zeólitas (Luz 1994). Isso permite que as zeólitas sejam usadas no processo de adsorção e troca iônica (Maia 2007).
Com a finalidade de minimizar problemas ambientais e produzir um material de alto valor agregado, a partir do rejeito de caulim supracitado, este trabalho tem por objetivo sintetizar Sodalita através do processo de extrusão descrito por Santos (2015). Extrusão é um processo de conformação plástica que consiste em passar um lingote ou tarudo sob pressão através de um orifício. Na conformação por extrusão o material é forçado através de uma matriz, produzindo praticamente qualquer forma de seção transversal, vazada ou cheia (Palmeira 2005). Assim, os produtos gerados na síntese seriam extrudados de forma cilíndrica, o que, conforme Li et al (2001) facilitaria sua aplicação no setor industrial, pois, nessa forma não ocorre o empacotamento em colunas de adsorção, fazendo com que esse processo seja mais eficiente.
MATERIAIS E MÉTODOS
O processo de síntese foi realizado em 3 etapas. A etapa 01 consistiu em tratamento térmico do rejeito de caulim (Kln) a 700°C/2h para se obter o metacaulim (MKln), pois segundo Maia et al (2014), são as condições ideais para se obter metacaulinita reativa. A etapa 02 incidiu na formação da mistura reacional em 3 proporções (MKln + NaOH + H2O), sempre formando uma pasta para que fosse possível realizar o processo de extrusão da mistura reacional.
A primeira série de sínteses dos materiais extrudados, secos, ocorreu à temperatura constante de 90 °C e tempos de 20 e 24 h, como na metodologia utilizada por Santos (2015). Nessa série foram realizadas 3 misturas reacionais. A primeira mistura foi realizada com a seguinte proporção, em termos molar: Na2O/Al2O3=0,1 e SiO2/Al2O3= 2. Sendo utilizada uma solução de NaOH a 5N. Na segunda, o NaOH foi utilizado no estado sólido e foi aumentada a quantidade de Na, sendo a relação Na2O/Al2O3 = 1,92, com SiO2/Al2O3= 2, além disso a essa mistura foram adicionados 2 mL de H2O. A terceira mistura foi realizada como a segunda, porém com relação: Na2O/Al2O3=0,69. Posteriormente, a mistura foi conformada, por uma extrusora manual, ilustrada na figura 1, a qual foi projetada e confeccionada por um professor do GMGA. Após a conformação, os materiais ilustrados na Figura 2 foram secos a 90°C/24h, formando os produtos apresentados na figura 3.
A última etapa de síntese consistiu no processo hidrotermal a 90ºC e 20 mL de H2O em 2 tempos de síntese 20 e 24h, considerando-se as três misturas reacionais acima aludidas. A 1ª mistura, após extrusão e secagem, passou por dois tempos de síntese, 20 e 24 h. Já a segunda e a terceira, o tempo utilizado somente foi de 24 h. Depois do processo hidrotermal todos os produtos obtidos foram lavados e filtrados até obter o pH 7 e em seguida secos em estufa por 24h à 90º C.
A segunda série de sínteses dos materiais extrudados, secos, foi realizada em tempos variados de 20, 24 e 48 h e temperatura de cristalização constante de 110°C.
Nesta fase, as duas misturas apresentavam a mesma relação molar SiO2/Al2O3=2 e variou-se Na2O/Al2O3 em 1,4 (mistura 1) e 1,92 (mistura 2). Nessas misturas, o NaOH estava no estado sólido e foi adicionado1 mL de H2O. Após a formação das misturas, estas também foram conformadas, pela extrusora manual, ilustrada na figura 1. Posteriormente, os materiais conformados foram secos a 110°C/2h.
Nesta segunda série de sínteses o processo hidrotermal foi realizado a 110ºC e 20 mL de H2O em 3 tempos de síntese 20, 24 e 48h, sendo consideradas as duas misturas descritas anteriormente. Após, extrusão e secagem, as misturas 1 e 2 passaram por três tempos de síntese, 20, 24 e 48h, em seguida todos os produtos obtidos foram lavados e filtrados até obter o pH 7 e depois secos em estufa por 24h à 110ºC.
CARACTERIZAÇÃO DOS MATERIAIS
Os materiais de partida foram caracterizados através de difratometria de raios X (DRX), microscopia eletrônica de varredura (MEV), e análise química. Já o produto final obtido em cada síntese foi caracterizado por DRX.
Os métodos de caracterização estão de acordo com as técnicas descritas por (Maia et al 2011) e todo o processo de caracterização dos materiais foi realizado no Instituto de Geociências da Universidade Federal do Pará.
Para calcular o tamanho dos cristalitos a equação de Scherrer (eq 1) foi utilizada.
A nomenclatura dos produtos da segunda série de experimentos é a seguinte: MX-T-t, em que X seria mistura 1 ou 2, já que variam em relação a relação NaO2/Al2O3, T, temperatura em graus Celsius e t, o tempo.
RESULTADOS E DISCUSSÕES
CARACTERIZAÇÃO DO MATERIAL DE PARTIDA
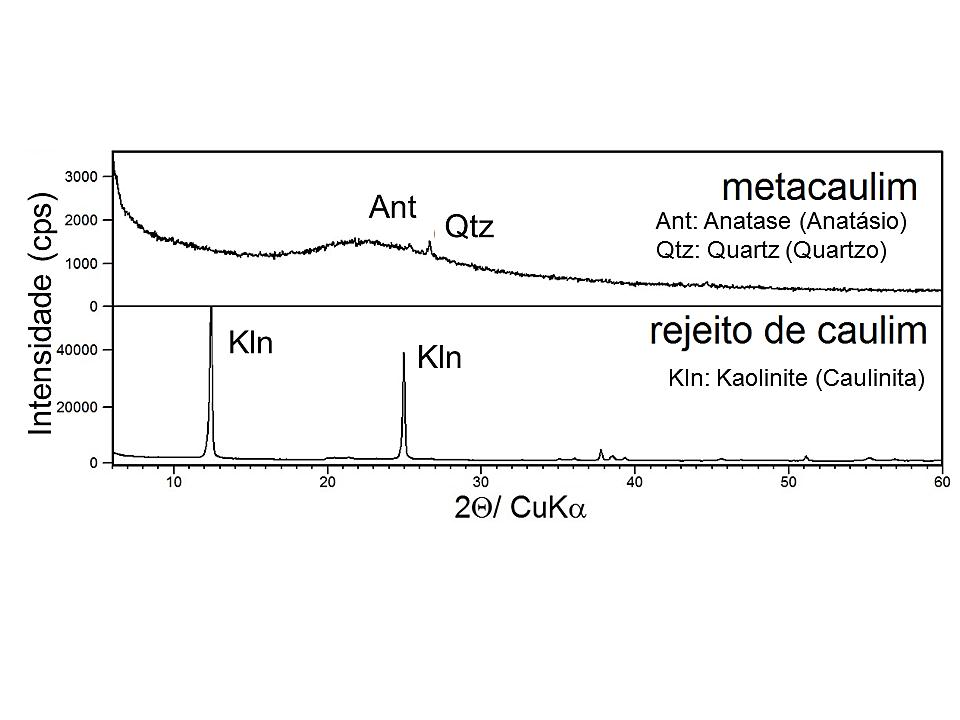
A Figura 4 apresenta os difratogramas de raios-x do resíduo de caulim e do mesmo calcinado.
A análise do difratograma do rejeito de caulim permite observar que o mesmo é constituído essencialmente por caulinita, pois, apresenta três picos principais do argilomineral. O difratograma do rejeito após o processo de calcinação mostra a transformação de caulinita em metacaulinita, isso devido ao rompimento completo da estrutura cristalina. Vale ressaltar, a presença de impurezas, identificadas pelos picos de quartz (Qtz) e anatase (Ant), o que conforme Maia (2007; 2011) estão sempre presentes nas ocorrências de caulim da região.
As imagens ao MEV do material de partida (caulim) e do material obtido (metacaulim) após o tratamento térmico do mesmo a 700°C/2h são apresentadas na figura 5.
Através dessas imagens é possível identificar que o caulim se constituiu essencialmente de muitas partículas aglomeradas com a morfologia de placas pseudo-hexagonal, com destaque para formas do tipo “booklets”, características do empilhamento dos cristais de caulinita. O metacaulim também apresentou cristais aglomerados e a morfologia pseudo-hexagonal se manteve. Em ambas as amostras, as partículas apresentam tamanho maior que 2 mm, como também é observado nas imagens do MEV dos trabalhos de Maia et al (2011), Hildebrando et al (2012).
Os resultados da análise química do rejeito de caulim do Capim e da perda ao fogo são apresentados na Tabela 1. Esses resultados mostram que o rejeito utilizado neste trabalho é constituído essencialmente por caulinita, pois, os teores de alumina, sílica e perda ao fogo se aproximam dos valores especificados por Santos (1995), de 39,50 % para o Al2O3 e de 46,54% para o SiO2. O valor de perda ao fogo, relativamente elevado se comparado ao do metacaulim, refere-se à quantidade de agua adsorvida, ou seja, com o aquecimento o material (caulim) libera hidroxilas o que causa a concentração dos outros elementos. Os demais constituintes encontrados no material são considerados como impurezas, a exemplo do TiO2 (0,35%) que está relacionado com o anatásio, já identificado anteriormente pela DRX.
Tabela 1. Composição química do rejeito de caulim
|
Componente |
% |
|
SiO2 |
46,11 |
|
Al2O3 |
38,27 |
|
Fe2O3 |
0,57 |
|
TiO2 |
0,35 |
|
CaO |
<0,01 |
|
MgO |
0,02 |
|
Na2O |
0,05 |
|
K2O |
0,14 |
|
PF |
14,46 |
|
Total |
99,98 |
PF: Perda ao fogo
PRODUTOS DE SÍNTESE
Por meio de difratometria de Raios-X foi verificado, para todas as amostras da primeira série de sínteses, que não houve a formação de nenhum tipo de zeólita, provavelmente, devido a temperatura de síntese que foi baixa (90°C) para esse processo.
Os difratogramas dos produtos formados, a partir, da segunda série de sínteses são apresentados nas Figuras 6 e 7. Foi possível observar nesses difratogramas picos característicos da sodalita (PDF 01-081-0705), com os seguintes parâmetros cristalográficos: sistema cristalino cúbico, grupo espacial P-43n, a ≅8,87. Assim, houve a formação de sodalita em todos os produtos de síntese e que mesmo aumentando a relação Na2O/Al2O3 de 1,4 (2ª série) para 1,92 (3ª série) e o tempo de cristalização, o perfil dos difratogramas permanece o mesmo.
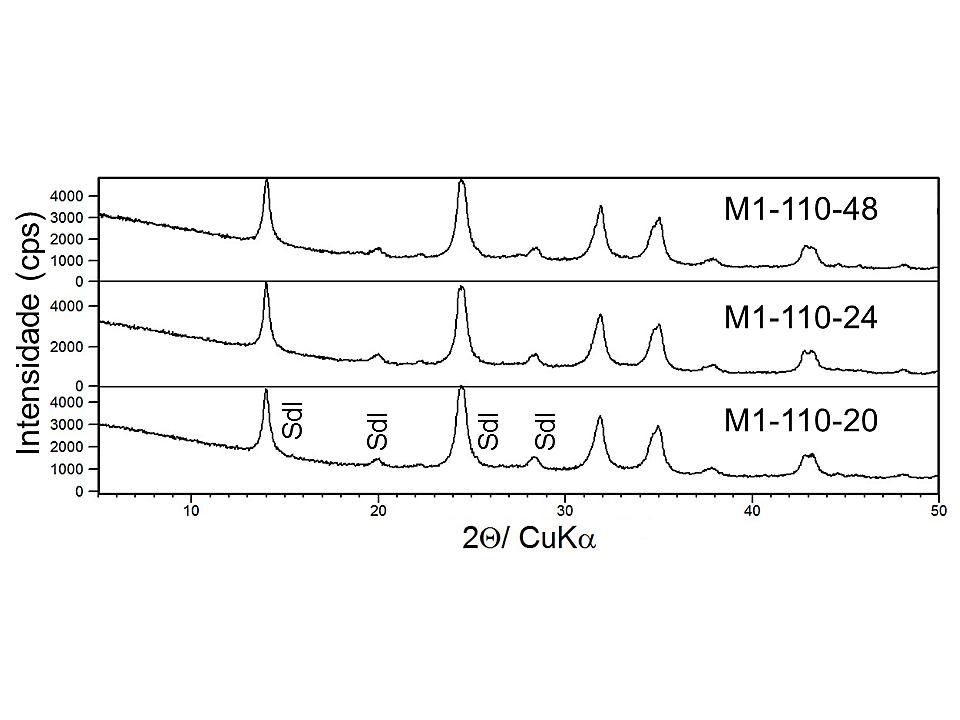
Figura 6. Difratogramas de raios X dos produtos M1-110-20, M1-110-24 e M1-110-48, onde Sdl representam os picos de Sodalite (Sodalita)
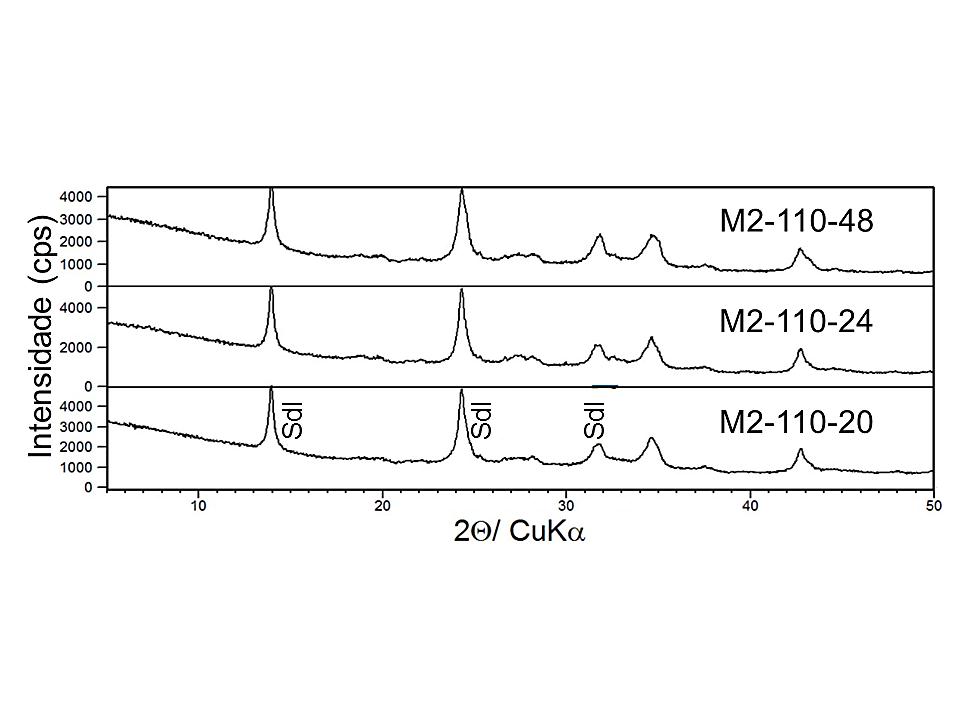
Figura 7. Difratogramas de raios X dos produtos M2-110-20, M2-110-24 e M2-110-48, onde Sdl representam os picos de Sodalite (Sodalita)
A Tabela 2 mostra a o tamanho de cristalito (D) e o valor da largura a meia-altura (FWHM) para o pico de maior intensidade da sodalita para as condições de síntese utilizadas:
|
Produtos de síntese |
FWHM (°) |
D (nm) |
|
M1-110-20 |
0,4605 |
18,48 |
|
M1-110-24 |
0,2047 |
41,48 |
|
M1-110-48 |
04605 |
18,48 |
|
M2-110-20 |
0,2302 |
36,93 |
|
M2-110-24 |
0,2047 |
41,48 |
|
M2-110-48 |
0,179 |
47,41 |
Tabela 2. Tamanho dos cristalitos das amostras sintetizadas
Para as amostras que foram produzidas a partir da mistura 1 (Na2O/Al2O3 =1,4), verifica-se que para os tempos de 20 e 48 h, o tamanho dos cristalitos permanece constante e aumenta no tempo de 24 h. Já para os produtos da mistura 2 (Na2O/Al2O3 =1,92), quando se aumenta o tempo de síntese, o tamanho do cristalito aumenta e a largura a meia-altura (FWHM) dos picos diminuem. Assim, para a mistura 1, o produto que foi sintetizado em 24 h pode ser considerado mais cristalino. Já para a mistura 2, com 48 h de cristalização, o produto apresenta maior cristalinidade em relação aos demais.
Em resumo, para o processo de síntese utilizado nesse trabalho, quando se aumenta a temperatura de cristalização para 110°C, a síntese da sodalita é beneficiada. O processo mais econômico foi aquele em que se utilizou a menor relação Na2O/Al2O3 (1,4) e menor tempo de síntese (20 h). Já para produzir sodalita mais cristalina, utiliza-se a maior relação Na2O/Al2O3 (1,92) e o maior tempo (48 h).
CONCLUSÕES
Este trabalho conseguiu demonstrar uma rota alternativa na síntese de sodalita, por meio da utilização do resíduo de caulim e do processo de extrusão. Dessa forma foi possível obter um produto final de formato cilindro, que poderá ser mais facilmente aplicado no setor industrial. As únicas variáveis do processo foram a temperatura, o tempo e as proporções dos reagentes utilizados, assim, em termos econômicos, as melhores condições foram: relação molar Na2O/Al2O3=1,4 e SiO2/Al2O3=2, e tempo de 20 h, mantendo-se a temperatura de 110°C. Logo este trabalho constitui-se como uma importante ferramenta de pesquisa no ramo da síntese de zeólitas, bem como, apresenta resultados relevantes para esta linha de pesquisa.
AGRADECIMENTOS
Agradeço às agencias financiadoras deste estudo, o Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq), a Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (Capes), a Universidade Federal do Pará (UFPA). Também ressalto a minha orientadora da bolsa de iniciação cientifica – Drª. Ana Áurea Barreto Maia – que além de me orientar, também me incentivou a desenvolver uma pesquisa com excelência, e os funcionários que são responsáveis pelos laboratórios de DRX e MEV da UFPA, campus Belém, que se empenharam em me apoiar nesta empreitada.
REFERÊNCIAS
Barata M. S. 2007. Aproveitamento dos Resíduos Cauliníticos das Indústrias de Beneficiamento de Caulim da Região Amazônica como Matéria-Prima para Fabricação de um Material de Construção (Pozolanas). Tese de Doutorado, Instituto de Geociências, Universidade Federal do Pará, Belém, 396p.
Flores S. M. P. & Neves R. F. 1997. Alumina para utilização cerâmica, obtida a partir do rejeito de beneficiamento de caulim. Revista Cerâmica, 43:283-284.
Hildebrando E. A., Angélica R. S., Neves R. F., Valenzuela-Diaz F. R. 2012. Síntese de zeólita do tipo faujasita a partir de um rejeito de caulim. Revista Cerâmica, 58:453-458.
IBRAM – Instituto Brasileiro de Mineração. Informações e análises da economia mineral Brasileira – 2012. 7ª edição. Disponível em http://www.ibram.org.br/sites/1300/1382/00002806.pdf. Acesso em 01/08/2018
Luz A. B. 1994. Zeólitas: propriedades e usos industriais. Série Tecnologia Mineral, 68: 37p, Rio de Janeiro.
Maia A. A. B. 2007. Síntese da Zeólita A Utilizando como Precursor um Rejeito de Beneficiamento de Caulim da Amazônia: Aplicação como Adsorvente. Dissertação (Mestrado em Engenharia Química), Instituto Tecnológico, Universidade Federal do Pará, Belém, 93f.
Maia, A. A. B. et al. 2007. Utilização de rejeito de caulim da Amazônia na síntese da zeólita A. Revista Cerâmica, 53:319-324.
Maia, A. A. B., Angélica R. S., Neves R. F. 2008. Estabilidade Térmica da Zeólita A Sintetizada a partir de um Rejeito de Caulim da Amazônia.
Revista Cerâmica, 54:345- 350.
Maia A. A. B. 2011. Desenvolvimento do Processo de Síntese da Zeólita A e da Sodalita a partir de Rejeitos de Caulim da Amazônia com Aplicações em Adsorção. Tese (Doutorado em Ciências) , Instituto de Geociências, Universidade Federal do Pará, Belém, 127 f.
Maia A. A. B., Angélica R. S., Neves R. F. 2011. Use of industrial kaolin waste from the Brazilian Amazon region for synthesis of zeolite A. Clay Minerals, 46:127–136.
Maia, A. A. B., et al. 2014. Use of 29Si and 27Al MAS NMR to study thermal activation of kaolinites from Brazilian Amazon kaolin wastes, Applied Clay Science, 87:189-196.
Maia A. A. B. et al. 2015a. Synthesis, optimisation and characterisation of the zeolite NaA using kaolin waste from the Amazon Region. Production of Zeolites KA, MgA and CaA. Applied Clay Science, 108:55-60.
Maia A.A.B., Neves R.F., Angélica R.S., Pöllmann H. 2015b. Synthesis of sodalite from Brazilian kaolin wastes. Clay Miner, 50:663–675.
Martelli M. C. 2006. Transformações térmicas e propriedades cerâmicas de resíduos de caulins das regiões do Rio Capim e do Rio Jarí- Brasil. Tese (Doutorado em ciências), Instituto de Geociências, Universidade Federal do Pará, Belém, 148 f.
Moraes C. G. et al. 2013. Produção de zeólita analcima a partir de caulim amazônico. Revista Cerâmica, 59:563-569.
Paz S. P. A., Angélica R. S., NEVES R. F. 2010. Síntese hidrotermal de sodalita básica a partir de um rejeito de caulim termicamente ativado. Química Nova, 33:579-583.
Palmeira, A. A. 2005. Curso Engenharia de produção processos de fabricação IV – Manual de processos de Extrusão. Universidade do Estado do Rio de Janeiro-RJ.
Rocha Junior C. A. F. 2015. Desenvolvimento de Processo para Obtenção de Zeólita tipo Faujasita a partir de Caulim de Enchimento, Caulim Duro e Tube Press: Aplicação como adsorvente. Tese (Doutorado em ciências), Instituto de Geociências, Universidade Federal do Pará, Belém, 127f.
Santana D.L. et al. 2012. Zeólita A sintetizada a partir de rejeitos do processo de Beneficiamento de caulim. Revista Cerâmica. 58:238-243.
Santos S. C. A. et al. 2013. Caulins amazônicos: possíveis materiais de referência. Revista Cerâmica, 59:431-441.
Santos S. C. A. 2015. Efeito do tempo de síntese de zeólita A a partir de caulim amazônico, conformação por extrusão e verificação desta na eficiência de adsorção de NH+4. Tese (Doutorado em ciências), Instituto de Geociências, Universidade Federal do Pará, Belém, 83f.