02 – CONTAMINAÇÃO POR NITRATO EM ÁGUAS DE POÇOS RASOS DESTINADAS AO CONSUMO HUMANO EM ICOARACI, MUNICÍPIO DE BELÉM, ESTADO DO PARÁ
Ano 10 (2023) – Número 3 - Obsidiana de Açores Artigos

10.31419/ISSN.2594-942X.v102023i3a2RCSC
Renata da Costa e Silva Crespim1, Bruno Santana Carneiro2, Paulo Pontes Araújo 3
1Mestre em Recursos Hídricos, Universidade Federal do Pará (UFPA), Belém, Pará.
2 Doutor em Saúde Coletiva, Instituto Evandro Chagas (IEC/SVS/MS), Ananindeua, Pará.
3 Doutor em Ciências Agrárias, Universidade Federal do Pará (UFPA), Belém, Pará.
ABSTRACT
The research aims to assess the water quality of shallow wells utilized by the local inhabitants of the Parque Guajará neighborhood, located in the Icoaraci District of Belém Municipality, State of Pará. This assessment was conducted in accordance with the criteria delineated by Ordinance GM/MS nº 888, an edict established by the Ministry of Health. In the year 2016, a series of samples were collected from 15 specifically chosen shallow wells. This sampling was arranged to align with the distinct climatic patterns of the region, spanning the rainy season (January and May) and the drier period (August and October). The investigation analyzed the following parameters: pH, electrical conductivity, nitrite, ammonium, and nitrate content. During the time of the sample collection phase, recorded pH values oscillated between 3.93 and 6.42, while the measurements of electrical conductivity exhibited a peak at 527 µS/cm. Notably, ammonium concentrations peaked during the rainy season at 6.01 mg/L, whereas nitrite levels reached their peak during the less rainy season at 0.44 mg/L. High nitrate levels were particularly observed, predominantly during the rainy season, increasing up to 64.03 mg/L. Signs of a nitrification process could be seen within the samples from two wells under investigation. Statistical analysis highlighted positive correlations between electrical conductivity and nitrate levels, as well as between pH and ammonium concentrations. Based on these data, it became evident that nitrate contamination was pervasive in the residual groundwater of the shallow wells. This nitrate contamination, a fundamental concern throughout the sampling period, under scored the significant influence of septic tank systems on the analyzed water. This contamination, in turn, threatens the well-being of the people who depend on these water sources for consumption, thereby requiring urgent attention.
Keywords: Nitrate; Nitrification; Shallow Wells
INTRODUÇÃO
A água é um recurso imprescindível para a manutenção da vida, contudo, é necessário estar livre de possíveis contaminantes para que possa ser utilizada de forma segura sem causar quaisquer riscos à saúde. Portanto, é de suma importância que este recurso esteja dentro dos padrões de potabilidade para ser de boa qualidade, já que a água é considerada um veículo potencial de contaminantes que podem afetar a saúde humana, tendo como base o Ministério da Saúde (2006), a ingestão de água com componentes nocivos é a forma mais lembrada quando se trata de doenças relacionadas à qualidade da água.
As águas subterrâneas são bastante propícias a diversos contaminantes que de acordo com o Ministério do Meio Ambiente (2007), estão frequentemente relacionados à construção sem critérios e uso de poços e fossas.
O consumo de águas subterrâneas é comum em locais onde o acesso ao abastecimento público de água é ineficiente ou até mesmo inexistente e esta ainda é uma realidade bastante presente no Brasil, e neste cenário, é válido citar a região Norte que sofre com a precariedade de saneamento básico. Dentro deste contexto, Trindade et al. (2017), destaca que a situação do saneamento básico na região metropolitana de Belém apresenta as mesmas condições relacionadas à região Norte, não tendo sistema de gestão pública eficiente, destacando a ausência de tratamento de lançamento de esgoto bem como a carência de abastecimento de água potável.
Sobre contaminantes em águas subterrâneas, Foster et al. (2006), frisa que os compostos nitrogenados têm forte associação com ‘’sistemas de saneamento in situ’’, assim como também é válido citar os fertilizantes nitrogenados utilizados em culturas como estudado por Lucena et al. (2013) que através da lixiviação contaminam águas subterrâneas. Os compostos nitrogenados têm o nitrogênio em sua formação e podem apresentar-se em diferentes estados de oxidação, e dentro deste grupo de compostos, levando em consideração a contaminação em águas, o nitrato merece atenção, que de acordo com Stradioto et al. (2019), em regiões urbanas, o nitrato se destaca como o contaminante mais frequente em águas subterrâneas, podendo atingir grandes extensões por sua estabilidade e alta solubilidade.
O nitrato é um íon que constantemente é visto com interesse quando o assunto é consumo de águas contaminadas e saúde humana por estar associado a casos de metemoglobinemia (AWWA, 1990).
Segundo a Organização Mundial da Saúde (1978), a relação de metemoglobinemia e a ingestão de nitrato em águas potáveis está associada à sua conversão para nitrito durante a digestão. A metemoglobina é a forma oxidada da hemoglobina, que além de não se ligar ao oxigênio, aumenta a afinidade deste pela porção parcialmente oxidada da hemoglobina (Nascimento et al, 2008), este evento afeta a oxigenação dos tecidos. Quando a concentração sanguínea de metemoglobina está acima de 1,5% surge a cianose, característica principal da doença (Nascimento et al, 2008).
Além da metemoglobinemia, a associação de nitrato a casos de câncer tem sido cada vez mais explorada em diversas pesquisas como observado por Barry et al. (2020) que realizaram trabalho relacionando a ingestão de nitrato em águas para abastecimento público vindas de poços privados a casos de câncer de bexiga, concluindo que a ingestão de nitrato é um fator de risco para este tipo de diagnóstico.
Portanto, diante do exposto, faz-se necessário desenvolver pesquisas para investigar a qualidade de águas direcionadas ao consumo humano, sendo este o objetivo deste artigo, tendo como enfoque a detecção de compostos nitrogenados comparando com a sazonalidade, e a determinação do grau de potabilidade das águas estudadas com base na Portaria GM/MS nº 888/2021 do Ministério da Saúde.
Este artigo é resultado da dissertação de mestrado denominada Qualidade das Águas Subterrâneas Rasas: Estudo de caso no Distrito de Icoaraci/PA, em que a interpretação dos resultados foi feita com base na Portaria 2.914/11 do Ministério da Saúde, no entanto para este artigo, os resultados foram interpretados de acordo com a Portaria nº 888 por ser a Portaria em vigor.
Área de Estudo
A área de estudo localiza-se no distrito administrativo de Icoaraci, inserido na porção norte da cidade de Belém. Avila de Icoaraci inclui 9 bairros, e um polo industrial com destaque para madeireiras, olarias, beneficiamento de palmito e pescados. Segundo dados do Instituto Brasileiro de Geografia e Estatística (2010), sua população é de 167.035 mil habitantes.
O clima na região é quente e úmido, com temperatura média de 25ºC em fevereiro e 26ºC em novembro. Segundo Bastos et al. (2002), de dezembro a maio é o período mais chuvoso, e tem precipitação provocada pela ITCZ- Zona de Convergência Intertropical. O final do período chuvoso ocorre entre os meses de junho a agosto, e os meses de setembro a novembro representam a fase de estiagem, ocorrendo precipitação por fenômenos de mesoescala.
A pesquisa foi desenvolvida no bairro de Icoaraci Parque Guajará, uma área de invasão, tendo como acesso principal a rodovia Augusto Montenegro. Segundo a Prefeitura Municipal de Belém (2011), a área é de 5.586.455,87 (m²),5,586 5 (km²) ou 58,65 (ha). A Figura 1 apresenta o local objeto da pesquisa, com destaque para a área onde foram feitas as coletas para este estudo.
A região estudada tem como forte característica a falta de saneamento básico, com esgotos a céu aberto, bem como a irregularidade na coleta de resíduos sólidos. A instabilidade do abastecimento de água nas residências do local merece destaque, obrigando a população residente a construir poços sem critérios e consumir águas que muitas vezes estão contaminadas, expondo-se constantemente a doenças de veiculação hídrica.
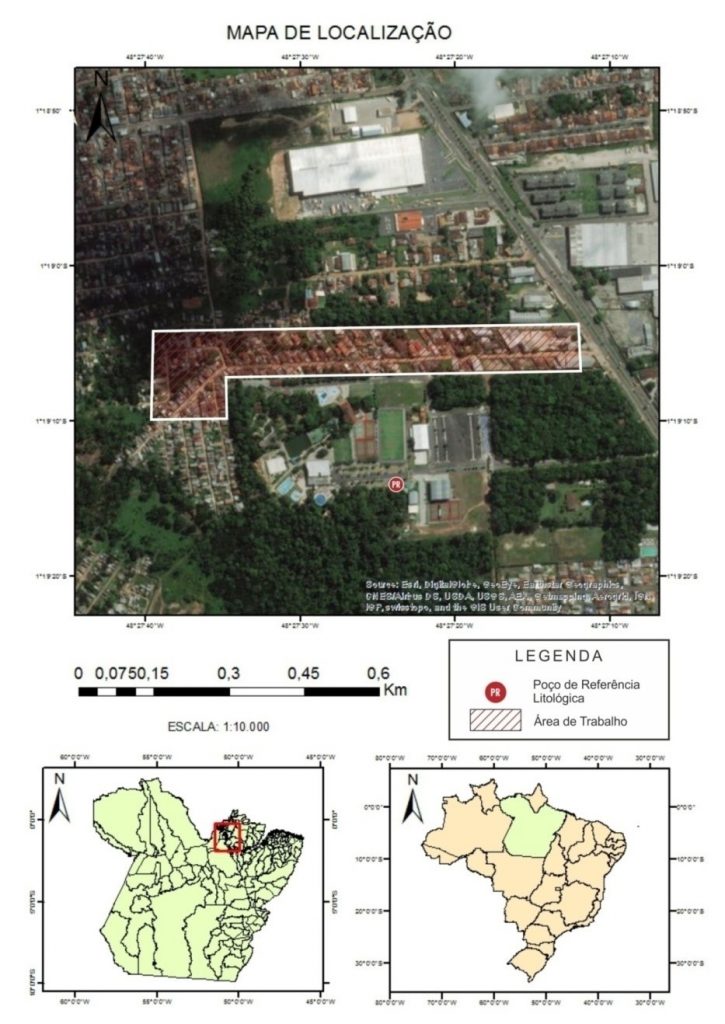
Figura 1- Mapa de localização e imagem da área de estudo detalhando o local de coleta
Fonte: Google Earth®. Acesso em 07/Jan/2017
MATERIAIS E MÉTODOS
Os poços cadastrados foram georreferenciados utilizando-se um GPS da marca GARMIN ETREX. No decorrer do cadastramento foram aplicados formulários para obter informações básicas dos poços, como profundidade estimada. Foi utilizada uma trena de 5 metros de comprimento para medir a distância entre poços e fossas, que foram consideradas fontes potenciais de contaminação na área de pesquisa.
Para compor a amostragem, foram selecionados 15 poços, sendo 04 manuais e 11 tubulares. A seleção dos poços ocorreu de acordo com a distribuição e a acessibilidade dos mesmos na área de estudo para a realização das coletas.
As coletas ocorreram nos meses de janeiro, maio, agosto e outubro de 2016. Os procedimentos de campo tiveram como base as instruções do Guia Nacional de Coleta e Preservação de Amostras da CETESB (2011).
Em poços manuais, as águas foram coletadas com o auxílio de amostrador, e em poços tubulares, em torneiras mais próximas aos poços.
Para as amostras, foram utilizados frascos de polietileno com capacidade de 1 litro, e durante as coletas das águas, utilizou-se luvas para procedimentos.
Após as coletas, as amostras foram armazenadas em caixa isotérmica com gelotes e levadas para análise à Sessão de Meio Ambiente do Instituto de Pesquisas Evandro Chagas.
O pH e a condutividade elétrica foram medidos por potenciometria com sonda multiparamétrica Professional Plus YSI®, calibrada previamente. Os íons Nitrito (N-NO2), Nitrato (N-NO3), Nitrogênio Amoniacal (N-NH3) foram analisados por cromatografia de íons em ICS2100DUAL (DIONEX ®, USA).
Todos os métodos e procedimentos analíticos foram executados de acordo com o Standard Methods for the Examination of Water and Wastewater (APHA/AWWA/WEF, 2012).
RESULTADOS
Os poços selecionados para as coletas apresentam profundidade estimada com variação de 6 a 24 m (Figura 2), e a distância destes até às fossas mais próximas, estas consideradas como fontes de contaminação na área de estudo, varia de 5,5 a 28 m. Trata-se de poços com profundidade rasa e que foram construídos próximos às fossas.

Figura 2 – Imagem capturada em 2016 mostrando um dos poços utilizado como ponto de coleta de amostras. Fonte: Imagem do Autor
De acordo com as Tabelas 1 e 2, a condutividade elétrica apresentou valores de 34 a 503 µS/cm durante o período chuvoso, e, valores de 65 a 527 µS/cm no período menos chuvoso, portanto no conjunto do range não apresenta variação, embora os valores estejam muito díspares. A condutividade elétrica reflete a presença de íons dissolvidos na água e se há alta concentração de íons, a condutividade será elevada. Como expostos nas Tabelas 1 e 2, os resultados de pH mostram variação de 3,93 a 6,44 no período chuvoso, e de 3,95 a 6,42 no período menos chuvoso, também com igual range em ambos os períodos. Quando comparados com o padrão estabelecido pela Portaria do Ministério da Saúde que recomenda águas para consumo humano com pH entre 6,0 e 9,0, os valores de pH só foram satisfatórios nas águas de um único poço amostrado, sendo as outras amostras com pH considerado ácido.
Tabela 1- Resultados de pH e condutividade elétrica durante o período chuvoso nas águas subterrâneas rasas estudadas.
| Período chuvoso (janeiro) | Período chuvoso (maio) | |||
| Poço | pH | Condutividade elétrica (µS/cm) | pH | Condutividade elétrica (µS/cm) |
| 1
2 3 4 5 6 7 8 9 10 11 12 13 14 15 |
4,36
4,34 4,32 5,38 4,56 4,65 4,58 5,98 5,15 4,31 6,44 5,74 4,96 4,98 4,92 |
113
131 95 42 62 34 86 109 193 116 86 148 503 150 80 |
4,05
3,93 4,21 5,30 4,37 4,38 4,61 5,84 4,70 4,37 6,19 4,73 5,47 4,51 4,68 |
149,0
220,0 139,0 79,0 151,0 85,0 87,0 103,0 108,0 147,0 77,0 146,0 488,0 148,0 83,0 |
Tabela 2 – Resultados de pH e condutividade elétrica durante o período menos chuvoso nas águas subterrâneas rasas estudadas
| Período menos chuvoso (agosto) | Período menos chuvoso (outubro) | |||
| Poço | pH | Condutividade elétrica (µS/cm) | pH | Condutividade elétrica (µS/cm) |
| 1
2 3 4 5 6 7 8 9 10 11 12 13 14 15 |
3,95
4,15 4,09 5,62 4,27 4,29 4,39 4,97 4,60 4,71 6,09 5,82 4,56 4,55 4,43 |
150,0
135,0 119,0 86,0 139,0 84,0 100,0 124,0 102,0 114,0 98,0 177,0 471,0 161,0 65,0 |
4,08
4,23 4,04 5,61 4,55 4,50 4,50 6,03 4,76 4,26 6,42 4,13 4,89 4,52 4,60 |
143,0
175,0 130,0 136,0 121,0 86,0 110,0 165,0 124,0 134,0 133,0 162,0 527,0 188,0 77,0 |
Os teores de nitrito são baixos (N-NO2ˉ) (Tabelas 3 e 4) sendo seu maior valor de 0,44 mg/L que ocorreu no período menos chuvoso. Este parâmetro apresentou valores dentro dos padrões da Portaria nº 888do Ministério da Saúde que é não ultrapassar 1 mg/L. Durante o período menos chuvoso o amônio (N-NH4+) apresentou variação de 0,0 mg/L a 4,59 mg/L, porém os resultados para este parâmetro tiveram destaque no período chuvoso, variando de 0,00 mg/L a 6,01 mg/L. Os resultados para nitrato foram bastante acentuados apresentando valores de 0,91 mg/L a 35,31 mg/L no período menos chuvoso e, destacando-se no período chuvoso com resultados que variaram de 3,71 mg/L a 64,03 mg/L, acima dos padrões estabelecidos pela Portaria nº888 que recomenda valor máximo de 10mg/L de nitrato.
Tabela 3 – Resultados de amônio (N-NH4+), nitrito (N-NO2ˉ) e nitrato (N-NO3ˉ) durante o período chuvoso nas águas subterrâneas rasas estudadas
| Período chuvoso (janeiro) | Período chuvoso (maio) | |||||
| Poço | N-NH4+ | N-NO2ˉ | N-NO3ˉ | N-NH4+ | N-NO2ˉ | N-NO3ˉ |
| 1
2 3 4 5 6 7 8 9 10 11 12 13 14 15 |
0,00
0,65 0,00 0,00 0,07 0,00 0,54 6,01 0,00 0,20 0,00 2,46 1,44 2,03 0,26 |
0,00
0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,4 0,00 0,00 0,00 |
31,25
34,45 22,17 7,39 10,96 7,23 16,13 16,09 36,78 19,00 11,53 20,97 21,89 17,08 4,69 |
0,00
0,00 0,00 0,00 2,27 0,69 0,00 4,40 0,00 0,00 0,00 2,14 0,00 2,25 0,00 |
0,00
0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 |
41,00
64,03 43,40 17,41 33,87 26,21 15,68 20,44 16,92 30,61 3,71 26,64 43,49 36,22 6,80 |
Tabela 4 – Resultados de amônio (N-NH4+), nitrito (N-NO2ˉ) e nitrato (N-NO3ˉ) durante o período menos chuvoso nas águas subterrâneas rasas estudadas
| Período menos chuvoso (agosto) | Período menos chuvoso (outubro) | |||||
| Poço | N-NH4+ | N-NO2ˉ | N-NO3ˉ | N-NH4+ | N-NO2ˉ | N-NO3ˉ |
| 1
2 3 4 5 6 7 8 9 10 11 12 13 14 15 |
0,00
0,00 0,00 0,00 2,47 0,72 0,00 4,59 0,00 0,36 0,00 2,23 0,00 2,47 0,35 |
0,00
0,19 0,15 0,00 0,00 0,00 0,00 0,26 0,00 0,44 0,00 0,16 0,17 0,00 0,15 |
25,82
29,60 21,71 8,77 22,55 15,54 17,15 18,32 8,66 15,34 2,34 0,91 30,79 23,18 5,23 |
0,00
0,00 0,00 0,00 0,51 0,00 0,00 4,49 0,00 0,00 0,00 0,00 0,01 1,58 0,00 |
0,00
0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 |
28,09
35,31 21,70 10,25 19,32 12,66 17,56 16,21 9,07 19,26 1,91 17,55 33,82 21,04 5,85 |
A análise estatística foi realizada através do coeficiente de correlação de Pearson entre os parâmetros analisados (Tabela 5) para determinação do grau de correlação entre eles, apontando correlação positiva entre pH e amônio, e entre condutividade elétrica e nitrato.
Tabela 5 – Matriz de correlação dos parâmetros analisados, onde p <,05000 indica correlações significantes. N=60.
| Parâmetros | Condutividade elétrica | pH | Nitrito | Nitrato | Amônio |
| Condutividade elétrica | 1 | 0,01 | 0,04 | 0,46 | 0,01 |
| p= — | p=,958 | p=,742 | p=,000 | p=,916 | |
| pH | 0,01 | 1 | 0,06 | -0,47 | 0,33 |
| p=,958 | p= — | p=,632 | p=,000 | p=,010 | |
| Nitrito | 0,04 | 0,06 | 1 | -0,06 | 0,17 |
| p=,742 | p=,632 | p= — | p=,631 | p=,186 | |
| Nitrato | 0,46 | -0,47 | -0,06 | 1 | -0,01 |
| p=,000 | p=,000 | p=,631 | p= — | p=,940 | |
| Amônio | 0,01 | 0,33 | 0,17 | -0,01 | 1 |
| p=,916 | p=,010 | p=,186 | p=,940 | p= — |
DISCUSSÕES
A Portaria nº 888 não fixa valores ideais para condutividade elétrica em águas para consumo, contudo, CETESB (2017) relaciona valores acima de 100 µS/cm a ambientes impactados. Portanto, os resultados de condutividade elétrica nas águas analisadas, são um forte indicativo de contaminantes, tendo como destaque o período menos chuvoso, em que esses valores se apresentaram mais elevados (Tabela 2). Rocha (2017) obteve valores elevados de condutividade elétrica chegando a 600 µS/cm durante período menos chuvoso em águas de poços no distrito de Marituba, região metropolitana de Belém. Já Hanna (2017), obteve resultado máximo de 44,3 µS/cm de condutividade elétrica durante período menos chuvoso em estudo realizado em poços na Ilha de Cotijuba, em Belém.
Como exposto na Tabela 3, o resultado máximo de amônio que foi de 6,01 mg/L ocorreu no período chuvoso. Hanna (2017), detectou teor máximo de 1,68 mg/L de amônio no período chuvoso. Como frisado por Araújo (2001), altos teores de amônio no período chuvoso podem estar associados à elevação do lençol freático, aumentando sua proximidade às fossas. Custódio e Llamas (1976), pontuam que valores de amônio que se apresentam acima de 0,06 mg/L são um forte indicativo de contaminação em águas subterrâneas. Embora a Portaria nº 888 não estabeleça valores para amônio, este composto representa contaminação futura em águas a partir de sua oxidação para nitrato (N-NO3ˉ).
As águas subterrâneas amostradas apresentaram pH ácido em sua maioria como expresso nas Tabelas 1 e 2. Durante pesquisa em águas de poços rasos no bairro do Tapanã, em Belém, Gonçalves (2017) observou pH ácido em 89% de suas amostras. O pH quando se apresenta na faixa ácida indica presença de matéria orgânica em decomposição, e esta relação pode ser observada na análise estatística (Tabela 5) onde a correlação entre pH e amônio foi positiva, ou seja, concentrações de amônio tendem a interferir no pH de águas, contribuindo para sua acidificação.
Apesar de ter apresentado valores baixos durante todo o período amostral, como apresentado nas Tabelas 3 e 4, o nitrito deve ser visto com cuidado, pois é um indicador bastante relevante de qualidade de águas, já que está relacionado a matéria orgânica, e porventura, contaminações. Portanto, vale levar em consideração que o poço 10 onde houve maior concentração de nitrito, está localizado a 5,5 m da fossa mais próxima. O nitrito é um composto que apresenta comportamento instável e sua baixa concentração nas águas analisadas expressa bem esta característica, pois é um componente intermediário no processo de nitrificação, ficando entre amônio e nitrato, indicando contaminação recente por matéria orgânica quando há condições favoráveis à sua transformação.
Nas águas amostradas, o nitrato chegou a exibir no período chuvoso teor de 64,03 mg/L (Tabela 3) observado no poço 2, que apresenta duas fossas em suas proximidades, o que pode ter exercido grande influência nesses resultados. Os poços 9 e 13 também merecem destaque por apresentarem teores marcantes de nitrato no período chuvoso, sendo 36,78 mg/L no mês de janeiro e 43,49 mg/L no mês de maio, respectivamente. Gonçalves (2017) detectou valor de 75,42 mg/ Lde nitrato durante período chuvoso, assim como Nogueira et al. (2021) detectaram valor de 22mg/L também no período chuvoso para este mesmo parâmetro, em Belém. Porém, Rocha (2017) obteve resultados mais expressivos de nitrato em águas de poços rasos durante o período menos chuvoso, chegando a 74,6 mg/L.
Na área de estudo foi observada a falta de critérios técnicos para construção de poços e fossas, bem como a inexistência de saneamento básico, sendo essa situação decisiva para os resultados obtidos, já que de acordo com Conselho Estadual de Recursos Hídricos de São Paulo (2019), fossas construídas de forma inadequada, assim como vazamento de rede de esgoto, são uns dos principais responsáveis pela elevação de nitrato em águas subterrâneas de áreas urbanas.
Os valores de nitrato ultrapassaram o máximo permitido de 10 mg/L pela Portaria nº888 em 86,67% das amostras analisadas no período chuvoso e 80% dessas amostras no período menos chuvoso.
O nitrato mostrou-se bem distribuído e persistente durante todo o período amostral, sendo possível verificar o seu típico comportamento estável em águas subterrâneas. O fato de valores de nitrato terem se apresentado de forma mais intensa no período chuvoso dá-se pela mesma explicação dos resultados de amônio citando Araújo (2001), em que a elevação do lençol freático facilita a proximidade com sistemas de saneamento in situ. A análise estatística (Tabela 5) mostrou correlação positiva entre condutividade elétrica e nitrato, expondo bem o comportamento da condutividade elétrica que tende a aumentar de acordo com a presença de íons.
Os resultados das amostras analisadas dos poços 12 e 15 que estão expostos nas Tabelas 3 e 4 indicam forte possibilidade de nitrificação. Com base em Baird (2002), a presença de compostos nitrogenados apresentando diferentes estados de oxidação indica contaminação das águas subterrâneas e condições higiênico-sanitárias precárias. Os resultados obtidos nas águas desses poços mostram variações alternadas nos teores de amônio e nitrato e como este fenômeno ocorreu em todos os períodos amostrais, conclui-se que, neste caso, possivelmente a sazonalidade não exerceu qualquer influência.
O amônio é oriundo de esgotos e está presente nos estágios iniciais do processo de decomposição de matéria orgânica, já o nitrato indica contaminação mais antiga, uma vez que está relacionado ao processo final de decomposição orgânica. Portanto, a presença de amônio e nitrato deixa clara a contaminação contínua, expondo o risco existente à saúde humana a partir do consumo dessas águas.
CONCLUSÕES
Dentre os parâmetros analisados destaca-se o pH que indica um comportamento ácido em todas as amostras, sendo que apenas o Poço 11 apresentou valores dentro da faixa recomendada pelo Ministério da Saúde. Para o amônio os maiores valores encontrados estão relacionados ao período chuvoso, o que contribui para que haja proximidade das águas dos poços com as fossas pela elevação do nível freático. Os valores para o parâmetro nitrito foram baixos em todo o período amostrado, o que pode estar relacionado a características do próprio composto, pois por ser instável, em condições favoráveis tende a transformar-se em nitrato.
O parâmetro nitrato foi o que mais evidenciou a contaminação na área estudada. Quando comparado à Portaria do Ministério da Saúde, que determina como valor máximo permitido de 10 mg/L, 80% das amostras analisadas no período menos chuvoso, e 86,67% das amostras no período chuvoso, o nitrato apresentou-se em desacordo com o preconizado pela referida Portaria.
Os resultados encontrados neste artigo apontam contaminação contínua e persistente por nitrato nas águas subterrâneas analisadas. Este fato mostra a exposição da saúde dos residentes do local de estudo, uma vez que utilizam essas águas para consumo.
Agradecimentos
Ao Programa de Pós-graduação em Recursos Hídricos da Universidade Federal do Pará, à CPRM e Sessão de Meio Ambiente do Instituto Evandro Chagas por todo apoio prestado durante o desenvolvimento deste trabalho, ao amigo Prof Dr Roberto Vilhena pelo suporte com as análises estatísticas, ao Sr Dico por ter viabilizado o contato com a comunidade residente da área de estudo, e ao amigo Rafael Guimarães pela revisão final do abstract.
REFERÊNCIAS
American Water Works Association (AWWA).1990. Water quality and treatment: a handbook of community water supplies. 4a ed. New York, McGraw Hill.
American Public Health Association. 2012. Standard methods for the examination of water and wastewater. 22 ed. Washington, American Public Health Association, 1360 p.
Araújo, P.P. 2001.Variações sazonais dos componentes nitrogenados em aqüíferos livres na zona urbana de Santa Isabel do Pará, Nordeste do estado do Pará. MS Dissertation, Instituto de Geociências, Universidade Federal do Pará, 113 p.
Baird, C. 2002. Química Ambiental. Porto Alegre, Bookman, 622p.
Barry K.H, Jones R.R, Cantor K.P, Beane Freeman L.E, Wheeler D.C, Baris D, et al. 2020. Ingested Nitrate and Nitrite and Bladder Cancer in Northern New England. Epidemiology.31(1):136-144. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6927574/pdf/nihms-1540883.pdf (acessado em 15/Nov/2022).
Bastos T.X; Pacheco N.A; Nechet D; Sá T.D.A. 2002. Aspectos climáticos de Belém nos últimos cem anos. 1. ed. Belém, Embrapa Amazônia Oriental, 31 p.
Brasil. Instituto Brasileiro de Geografia e Estatística.2010. Atlas do Saneamento. https://www.ibge.gov.br/apps/atlas_saneamento/#/home (acessado em 06/Fev/2022).
Brasil. Ministério do Meio Ambiente/MMA.2007. Águas Subterrâneas: Um recurso a ser conhecido e protegido. 1.ed. Brasília, Agência Crio, 40 p.
Brasil. 2021. Ministério da Saúde. Portaria GM/MS nº 888 de 04 de maio de 2021. https://bvsms.saude.gov.br/bvs/saudelegis/gm/2021/prt0888_07_05_2021.html (acessado em 11/Fev/2022).
Brasil. Ministério da Saúde. 2006. Vigilância e controle da qualidade da água para consumo humano. https://bvsms.saude.gov.br/bvs/publicacoes/vigilancia_controle_qualidade_agua.pdf (acessado em 20/Fev/2022).
Companhia Ambiental do Estado de São Paulo.2011. Guia nacional de coleta e preservação de amostras: água, sedimento, comunidades aquáticas e efluentes líquidos. https://cetesb.sp.gov.br/wp-content/uploads/2021/10/Guia-nacional-de-coleta-e-preservacao-de-amostras-2012.pdf (acessado em 25/Fev/2022).
Companhia Ambiental do Estado de São Paulo.2017. Qualidade das águas doces no estado de São Paulo: Significado ambiental e sanitário das variáveis de qualidade das águas e dos sedimentos e metodologias analíticas e de amostragem. Apêndice E. https://cetesb.sp.gov.br/aguas-interiores/wp-content/uploads/sites/12/2017/11/Ap%C3%AAndice-E-Significado-Ambiental-e-Sanit%C3%A1rio-das-Vari%C3%A1veis-de-Qualidade-2016.pdf (acessado em 13/Fev/2022).
Conselho Estadual de Recursos Hídricos.2019. Nitrato nas águas subterrâneas: desafios frente ao panorama atual. Câmara Técnica de Águas Subterrâneas, São Paulo. http://www.comiteps.sp.gov.br/arquivos/documentos/36/nitrato.pdf (acessado em 12/Mar/2022).
Custodio, E, Llamas, M.R.1976. Hidrogeologia subterrânea. Vol 2. Barcelona, Omega, 1157p.
Foster S, Hirata R, Gomes D, D’Elia M, Paris M. 2006. Proteção da qualidade da água subterrânea: um guia para empresas de abastecimento de água, órgãos municipais e agências ambientais. São Paulo, Servmar, 104 p.
Gonçalves, D.F.M. 2017. Qualidade das águas subterrâneas no Conjunto Residencial Benedito Monteiro do bairro Tapanã em Belém-PA. MS Dissertation, Instituto de Geociências, Universidade Federal do Pará, 152 p.
Google Earth.http://earth.google.com/ (acessado em 07/Jan/2017).
Hanna, L.M.M. 2017. Qualidade das águas subterrâneas rasas na ilha de Cotijuba – Belém/PA. MS Dissertation, Instituto de Geociências, Universidade Federal do Pará, 129 p.
Lucena L.R.F, Dantas J.A, Medeiros A.A, Rosa Filho E.F. 2013. A lixiviação de fertilizantes nitrogenados na zona vadosa superior como indicativo de risco de contaminação do aquífero barreiras-área da bacia do rio Catu-RN, NE do Brasil. Águas Subterrâneas,27(1). https://aguassubterraneas.abas.org/asubterraneas/article/view/27338 (acessado em 08/Nov/2022).
Nascimento T.S, Pereira R.O.L, Mello H.L.D, Costa J.2008.Metemoglobinemia: do Diagnóstico ao Tratamento. RevBrasAnestesiol, 58:(6): 651-664.
Nogueira,M.H.P, Crespim, R.C.S, Carneiro B.S. 2021. Análise e diagnóstico da qualidade da água de um residencial localizado em Belém do Pará. RCT, 7.https://revista.ufrr.br/rct/article/view/6810/3382 (acessado em 20/Ago/2023).
Organização Mundial da Saúde. 1978. Nitrates, nitritesandN-nitrosocompounds. Geneva, 97 p.
Prefeitura Municipal de Belém. Anuário Estatístico do Município de Belém 2011. http://www.belem.pa.gov.br/app/ANUARIO_2011/ANUARIO%202011%20COMPLETO.pdf (acessado em 11/Out/2022).
Rocha, A.L.G.A. 2017. Qualidade das águas subterrâneas rasas do bairro centro do município de Marituba-PA e sua relação com as principais fontes potenciais de poluição. MS Dissertation, Instituto de Geociências, Universidade Federal do Pará, 91 p.
Stradioto M.R, Teramoto E.H, Chang H.K. 2019. Nitrato em águas subterrâneas do estado de São Paulo. Revista do Instituto Geológico, 40 (3), 1-12.
Trindade A.B, Guedes M.P , Bordalo C.A.L, Monteiro N.R.G. 2017. A gestão do serviço público e abastecimento de água potável na região metropolitana de Belém: o caso do município de Ananindeua – Pará – Brasil. In: I Congresso Nacional de Geografia Física, Campinas, p. 667-678. https://ocs.ige.unicamp.br/ojs/sbgfa/article/view/1940 (acessado em 17/Ago/2023).
