01 – SÍNTESE, CRESCIMENTO E CARACTERIZAÇÃO DE ACETATOS DE Ca(AC, CRISTAIS DE VINAGRE), EXTRAPOLANDO A SALA DE AULA COM ALUNOS DA EDUCAÇÃO BÁSICA
Ano 10 (2023) – Número 3 - Obsidiana de Açores Artigos

10.31419/ISSN.2594-942X.v102023i3a1GJV
Glayce Valente1*
Heitor Valente2,
Thamyres Martins do Rego3,
Manuela de Souza Soares3,
Ana Luisa dos Santos Brasil4,
Davi do Socorro Barros Brasil5,
Marcondes Lima da Costa6
José de Arimateia Rodrigues do Rego7,
1PPGPatri/UFPA, glaycej@yahoo.com.br
2Centro Educacional Kyoko Oti
3Colégio Ideal
4Colégio São Paulo
5Instituto de Tecnologia/UFPA
6Instituto de Geociências/UFPA
7Instituto de Ciências Exatas e Naturais ICEN/UFPA
*Autor para correspondência.
ABSTRACT
Experiments conducted at room temperature using vinegar (which contain 4 to 6% acetic acid) and pieces of granite-type flooring as precursors, for the synthesis of Ca acetate (AC) crystals by elementary school students I and II. The product formed was characterized using the techniques of DRX, portable FRX, benchtop SEM-EDS and binocular stereoscopic microscope support with attached camera. This work reports a simple, low-cost method with no environmental impact for the synthesis of CA.
Keywords: Ca acetate, mineralogy, crystals synthesis
INTRODUÇÃO
A cristalização é o processo de formação de cristais sólidos a partir de solução, fusão ou deposição diretamente de uma fase gasosa. Em caso de solução éobtida através da interação entre soluto/solvente, variando as condições de solubilidade e difere à simples precipitação envolvida em uma reação química. Sua empregabilidade é vasta na indústria e frequentemente encontrada na síntese de produtos farmacêuticos, por exemplo.Para que ocorra é necessária a separação do soluto da corrente líquida que o alimenta, por resfriamento ou por excesso de soluto (supersaturação). O processo consiste em dois eventos, a nucleação e o crescimento do cristal.
Entre as forças intermoleculares que atuam na formação de cristais, temos as de Van der Walls, dipolo-dipolo e ligações de hidrogênio, sendo que a o crescimento da rede cristalina, ocorre sob uma lenta taxa de velocidade, camada por camada, ordenando a estrutura tridimensional por ligações entre os átomos, moléculas ou íons que constituírem a substância. Sendo que operfeito posicionamento de cada molécula ou íon na rede ao sair da solução tende a gerar cristais bem formados e puros. Mesmo assim, as impurezas presentes na solução podem ou não permanecer nela comprometendo a pureza do produto, ou o próprio solvente pode formar um solvato na rede ou mesmo uma inclusão dentro do cristal (Costa & Giuliette 2010).
O acetato de cálcio (Ca(CH3OO)2·2H2O, AC), também conhecido como acetato de cal e sais de vinagre, é um sal do ácido acético, e, portanto, obtido a partir da reação com o ácido acético, que é um ácido carboxílico, nomenclatura IUPAC ácido etanoico, e CaCO3, derivado de diferentes fontes de Ca (Dionysiou et al. 2000, Jiang et al. 2010, Thongkam et al. 2021). Fases de AC são observadas como sais de eflorescência em uma ampla gama de materiais porosos, fósseis, cerâmica e calcário, armazenados por longos períodos em móveis de madeira (especialmente carvalho) que propaga uma atmosfera de ácido acético (Hibbs et al. 2002, Gibson et al. 2005, Paterakis and Steiger 2014, Bette et al. 2018, Bette et al. 2020). Os hidratos de AC são muito comuns, em vários níveis, visto o elevado grau higroscópico de sua forma anidra, identificando-se seu hemi-hidratado como produto intermediário da decomposição térmica do acetato monohidratado (Paterakis and Steiger 2014, Dionysiou et al. 2000, Bette et al. 2020, Panzer 1962).
Por haver interesse comercial, o AC é frequentemente produzido em escala industrial, de maneira que sua síntese vem sendo relatada com a utilização de fontes alternativas de Ca, a fim de diminuir os custos usuais de produção. Dentre estes, o aproveitamento de resíduos gerados pela indústria agroalimentar como cascas de ovos, farinha de osso e conchas oferecem uma proposta de gestão sustentável de resíduos com geração de produtos com valor agregado (Nobre et al. 2020, Thongkam et al. 2021, Seesanong et al. 2023, Strelec et al. 2023, Yao et al. 2022). Além dos biomateriais, materiais de origem geológica e resíduos industriais como calcário, mármore, dolomita, magnesita e escória de aço também são avaliados como fontes promissoras de cálcio e magnésio (Amghar et al. 2023, Feng et al. 2023). O presente trabalho teve como objetivo sintetizar sais de vinagre utilizando materiais comuns do uso cotidiano por estudantes do ensino fundamental I e II, sob baixo custo de produção.
CaCO3 + CH3COOH -> Ca2+ + CH3COO– + CO2 + H2O
Ca2+ + CH3COO– -> Ca(CH3COO)2
MATERIAIS E MÉTODOS
Utilizou-se vinagre comercial (solução aquosa de ácido etanoico com 4-6%, CH3COOH)e pedaços de piso, tipo granilite como fonte de Ca. Em copos descartáveis foram adicionados pequenos pedaços de granilite (10 a 15 g) e, na sequência 50 ml de vinagre, sem empregar qualquer tipo de tratamento físico (Figura 1). O conjunto soluto-solvente foi deixado em repouso por 24 h, observando-se o completo desprendimento do dióxido de carbono e, em seguida, retirou-se parte dos fragmentos de granilite utilizado para gerar saturação por transferência dos íons cálcio, deixando em repouso um único fragmento como núcleo para iniciar a cristalização. O conjunto soluto-solvente permaneceu por 30 dias até completa evaporação do solvente e foi monitorado visualmente pelos estudantes.
Os cristais obtidos foram caracterizados por DRX em um equipamento D2 PHASER (BRUKER Incorp.), com tubo de anodo de Cu Kα1=1,54184 [Å], detector Lynxeye, operando a 30 kV e 10 mA (300 W), entre 5ºe 75º (2θ), com incremento de 0,02 (2θ), tempo de passo 0,2 s, fenda de 1 mm,via método do pó.A micromorfologia e composição química semi-quantitativaforam observados em um MEV (Hitachi, TM 3000) com Sistema de Energia Dispersivo (Oxford 3000) operado via software Swift ED, sob um sistema de baixo vácuo, sem metalização, tensão de aceleração de 15kV, corrente de emissão de 32 nAe corrente do filamento de 1,75 mA. A composição química foi ainda determinada pela técnica de FRX (BRUKER Incorp.), um sistema portátil, modelo S1 Turbo, tipo de análise direta em material sólido, sem empregar qualquer método de digestão química. Estes procedimentos foram realizados no Laboratório de Mineralogia, Geoquímica e Aplicações (LaMiGA-Raios-X/MEV-EDS), no Museu de Geociências (PPGG-UFPA). Enquanto imagens obtidas por microscópio estereoscópio binocular com câmera acoplada foram extraídas no Laboratório de Ecologia do Instituto de Biologia da UFPA (LABECO-ICB-UFPA).

Figura 1. Etapas da execução e determinação dos produtos do experimento, realizada por alunos da educação básica e tutorada por professores.
RESULTADOS E DISCUSSÕES
A formação dos cristais de AC foi observada logo nas primeiras semanas que sucederam o total desprendimento do dióxido de carbono e retirada do excesso de fragmentos de granilite, em que o ácido acético transferido para a fase aquosa reage com o carbonato para formar acetato, quando a supersaturação é atingida ocorre a cristalização (Figura 2). Incialmente houve a formação de pequenos aglomerados brancos, com morfologias semelhantes a nuvens ou pipocas, visível a olho desarmado, após completa evaporação da solução, nota-se que o produto final difere a uma morfologia homogênea (Figura 3). Hastes como cristais de aglomerados também são identificadas, como destacadas nas imagens obtidas por estereoscópio e MEV (Figuras 3 e4), além de incrustações compactas, notadas ao MEV (Figura 4). Ainda que a mineralogia apontada por DRX destaque unilateralmente a presença de acetato de cálcio monohidratado (Figura 5), teores de Mg foram registrados pelo Sistema de Energia Dispersivo e FRX, proporcionalmente bem inferiores ao Ca (Tabelas 1 e 2).

Figura 3. Morfologia heterogênea dos cristais obtidos observadas ao estereoscópio microscópio. a e b: aglomerados agulhas aciculares (cristais de AC); c e d: aglomerados nuvens ou pipocas (AC + impurezas).

Figura 4 – Micromorfologia dos cristais observados ao MEV. Ponto analisado por EDS. De a a e: aglomerados agulhas aciculares ou hastes como cristais de aglomerados (cristais de AC) observados em diferentes escalas de resolução; f: aglomerados com morfologias semelhantes a nuvens ou pipocas e incrustações compactas depositadas sobre as hastes.
Tabela 1. Composição química semi-quantitativa (EDS) relacionada a imagem (MEV).
| EDS | Figura b | Figura c | Figura d | Figura f |
| C (%) | 19,1 | nd | 23,6 | 7,1 |
| O (%) | 36,5 | 57,7 | 44,4 | 30,9 |
| Mg (%) | nd | 0,5 | 3,7 | nd |
| Ca (%) | 44,6 | 25,2 | 27,8 | 60 |
| Outros elementos* (%) | nd | 16,6 | 0,5 | 2 |
*soma de K, Cl, Na, S, Mo
nd: não detectado
Os resultados químicos semi-quantitativos (EDS) associados a imagem (MEV) apontam a morfologia dos cristais de acetato de cálcio. Nos cristalitos em forma de agulhas, prevalece a composição em Ca, C e O, enquanto que nas demais morfologias traços de K, Cl, Na, S e Mg (<0,5%) foram detectados na maioria dos pontos analisados. A composição química expressa por FRX também destaca a imponência do CaO, cerca de 70 %, com presença de Mg, mesmo considerando as limitações de análise na detecção do elemento (Tabela 2). A cristalização de acetato de cálcio é favorecida em baixas concentrações de ácido acético e temperatura ambiente, as mesmas utilizadas no experimento, enquanto a cristalização de acetato de magnésio requer altas concentrações de ácido acético e altas temperaturas, fatores que podem ter afetado a sua cristalização, além da possível carência na fonte rochosa utilizada (Dionysiou et al. 2000).
Tabela 2. Composição química determinada por FRX.
| Elemento | (%) |
| MgO | 9,5±4,4 |
| Al2O3 | 2,9±0,9 |
| P2O5 | 1,1±0,1 |
| CaO | 66,9±0,1 |
| Cl+K2O+Fe2O3+Cu | 0,7±0,01 |
| LOI* (C, H ou H2O) | ~ 19.00 |
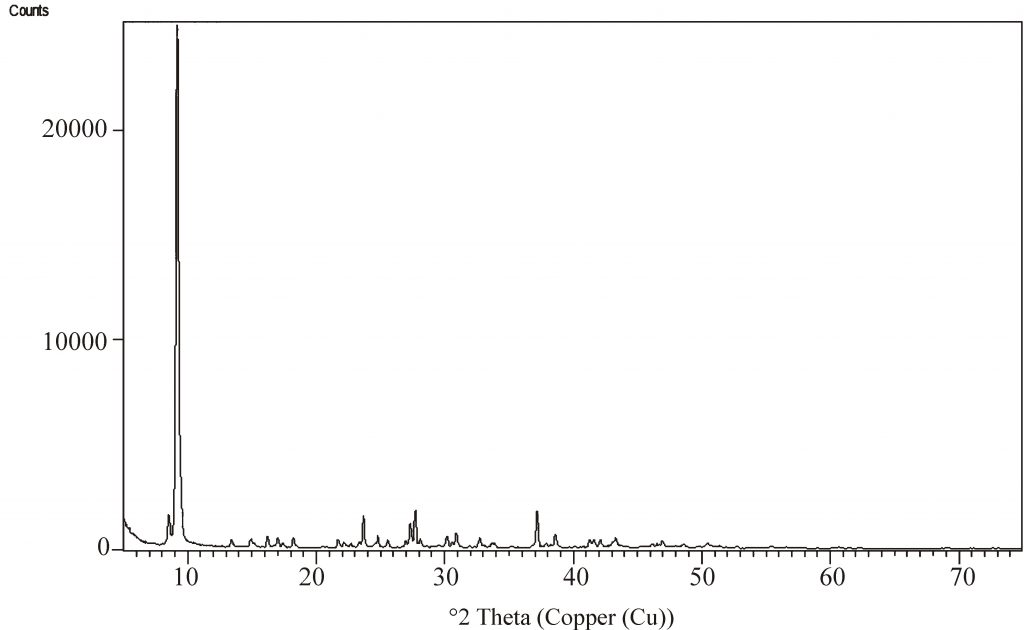
Figura 5 – Espectro de DRX dos cristais de acetato de cálcio, produzidos a partir de pedaços de granilite e vinagre comercial.
CONCLUSÕES
A realização de experimentos de baixo custo pode aguçar a curiosidade e o entendimento da formação de cristais de alunos da Educação Básica. Cristais de acetato de cálcio podem ser produzidos usando ácido acético comercial (vinagre), que mesmo apresentando impurezas, visto que não foi empregado nenhum método de purificação na síntese, foram detectadas por técnicas analítica e de imagens. A caracterização morfológica apontou heterogeneidade na formação dos cristais, provavelmente devido as presente na matéria-prima empregada, conforme observadas na composição química detalhada por EDS e expressa por FRX.Os estudantes executaram com êxito o experimento proposto obtendo majoritariamente cristais de acetato de cálcio. Os experimentos realizados foram muito prazerosos para os estudantes e professores que conduziram o processo de ensino-aprendizagem usando a experimentação.
REFERÊNCIAS
Amghar,N.; Jiménez, P. E. S.; Maqueda, L. A. P.;Perejon, A.2023. Thermochemical energy storage using calcium magnesium acetates under low CO2 pressure conditions. Journal of Energy Storage, 63, 106958.
Bette, S.; Eggert, G.; Fischer, A.; Stelzner, J.; Dinnebier; R. E. 2018. Characterization of a new efflorescence salt on calcareous historic objects stored in wood cabinets: Ca2(CH3COO)(HCOO)(NO3)2·4H2O. Corrosion Science, 132, 68-78.
Bette, S.; Stelzner, J.; Eggert, G.; Schleid, T.; Matveeva, G.; Kolb, U.; Dinnebier, R.E. 2020. Corrosion of Heritage Objects: Collagen-Like Triple Helix Found in the Calcium Acetate Gemihydrate Crystal Structure. Angew. Chem. Int., 59, 9438-9442.
Costa, Caliane B. B. Introdução à cristalização: princípios e aplicações / Caliane B. B. Costa, Marco Giulietti. São Carlos: EdUFSCar, 2010. 91 p. (Coleção UAB-UFSCar).
Dionysiou, D.; Tsianou, M.; Botsaris, G. 2000. Extractive Crystallization for the Production of Calcium Acetate and Magnesium Acetate from Carbonate Sources. Ind. Eng. Chem. Res. 39, 4192-4202.
Feng, Q.; Song, Y; Lu, C.; Fang, H.; Huang, Y.; Chen, L.; Song, X. 2023. Feasible Utilization of Waste Limestone as a Calcium Source for Microbially Induced Carbonate Precipitation (MICP). Fermentation, 9, 307.
Gibson, L. T.; Cooksey, B. G.; Littlejohn, D.; Linnow, K.; Steiger, M.; Tenne, N. H. 2005. The Mode of Formation of Thecotrichite, a Widespread Calcium Acetate Chloride Nitrate Efflorescen. Studies in Conservation 50, 284-294
Hibbs, D. E.; Kolitsch, U.; Leverett, P.; Sharpe, J. L.; Williams, P. A. 2002. Hoganite and paceite, two new acetate minerals from the Potosi mine, Broken Hill, Australia. Mineralogical Magazine, Vol. 66(3), pp. 459–464.
Jiang, X; Li, G; Wu, Z. 2010. Deicing and Corrosive Performances of Calcium Acetate Deicer Made from Bamboo-Vinegar. International Journal of Chemical and Molecular Engineering. Vol (4), Nº5.
Nobre. L.C.S. ; Santos, S.; Palavra,A. M.F.;Calvete, M. J.F.; de Castro, C. A. N.; Nobre, B. P. 2020. Supercritical antisolvent precipitation of calcium acetate from eggshells. The Journal of Supercritical Fluids, 163.
Panzer, J. 1962. Nature of calcium acetate, J. Chem. Eng. Data. 7,140–142
Paterakis, A. B. & Steiger, M. S. 2015. Salt efflorescence on pottery in the Athenian Agora: A closer look. Studies in Conservation, Vol (60), N (3).
Seesanong, S.; Seangarun, C.; Boonchom, B.; Laohavisuti, N.; Montri, N.; Thompho, S.; Boonmee, W.; Mongkol, S.; Rungrojchaipon, P. 2023. Bio-green synthesis of calcium acetate from oyster shell waste at low cost and reducing the emission of greenhouse gases. Research Square.
Strelec, I.; Tomičić, K.; Zajec, M.; Ostojčić, M.; Budžaki, S. 2023. Eggshell-Waste-Derived Calcium Acetate, Calcium Hydrogen Phosphate and Corresponding Eggshell Membranes. Appl. Sci. 13, 7372.
Thongkam, M.; Saelim, J.; Boonchom, B.; Seesanong, S.; Chaiseeda, K.; Laohavisuti, N.; Bunya-atichart, K.; Boonmee, W.; Taemchuay, D. 2021. Simple and Rapid Synthesis of Calcium Acetate from Scallop Shells to Reduce Environmental Issues. Adsorption Science & Technology.
Yao, Y.; Zhang, J.; Zhang, R.; Shi,Y.; An, P.; Hu, X.; Wan, Y. 2022. Optimization of preparation of calcium acetate from eggshell by Response Surface Methodology (RSM). Food Sci. Technol, 42, 114421.

